Simple comme une symbiose !
Chaque espèce présente dans un écosystème entretient avec une partie de la biocénose des relations privilégiées, qu’elles soient à son avantage ou en sa défaveur. Ces relations entre individus d’espèces différentes jouent des rôles très importants dans le fonctionnement des communautés d’êtres vivants mais aussi dans celui de l’écosystème tout entier. La prédation de la Chouette effraie sur ses proies échantillonnées parmi les micromammifères (souris, mulots, campagnols, musaraignes) de son territoire, contribue par exemple à réguler les populations de ceux-ci. La compétition pour l’accès à la lumière entre de jeunes arbres d’essences différentes dans un sous-bois, est le mécanisme qui façonne l’identité de nos forêts. Trop longtemps cependant, les relations de coopération ont été délaissées par les écologues et leur importance sous-estimée par rapport à celle de la compétition entre espèces ou de la prédation. Pourtant, les mutualismes et tout particulièrement les symbioses, comptent parmi les relations les plus structurantes des écosystèmes. Les coraux qui abritent au sein même de leurs cellules des algues microscopiques (des Dinoflagellés du genre Symbiodinium) construisent grâce à l’apport de sucres dérivés de la photosynthèse de ces algues, d’énormes édifices offrant à une faune extrêmement diversifiée un nombre considérable de niches écologiques, soutenant ainsi une productivité exceptionnelle dont les populations humaines tirent profit.
Photographie d'une Anémone verte (Anemonia viridis) sur une plage européenne où elle est commune. Les cellules des tentacules verts de cet animal renferment des algues unicellulaires Dinoflagellés du genre Symbiodinium couramment appelées zooxanthelles. Ces algues réalisent la photosynthèse à l'abri dans les cellules de l'anémone qui reçoit un apport important de sucres en échange de cette protection. (Photo : howzey)
Sous nos pieds, les racines de la plupart des plantes herbacées comme ligneuses sont associées à des champignons et ou à des bactéries qui leur permettent d’améliorer leur nutrition minérale en échange de produits de la photosynthèse. De nombreuses plantes à fleurs ont également des partenaires bourdonnant sur lesquels elles comptent pour disperser leur pollen au prix de la sécrétion de nectar, délicat salaire pour ces forçats que sont les abeilles, les bourdons, les papillons et autres mouches… Les quelques exemples de symbioses classiquement utilisés dans les cours sur le sujet montrent une certaine complexité de la relation telle qu’elle est observée aujourd’hui si bien que son origine et sa mise en place constituent une énigme. Dans quel contexte un tel partenariat est-il scellé ? La naissance d’une symbiose est-elle conditionnée à une longue histoire commune entre les organismes concernés ? En d’autres termes, y a-t-il forcément coévolution avant le démarrage d’une symbiose ?
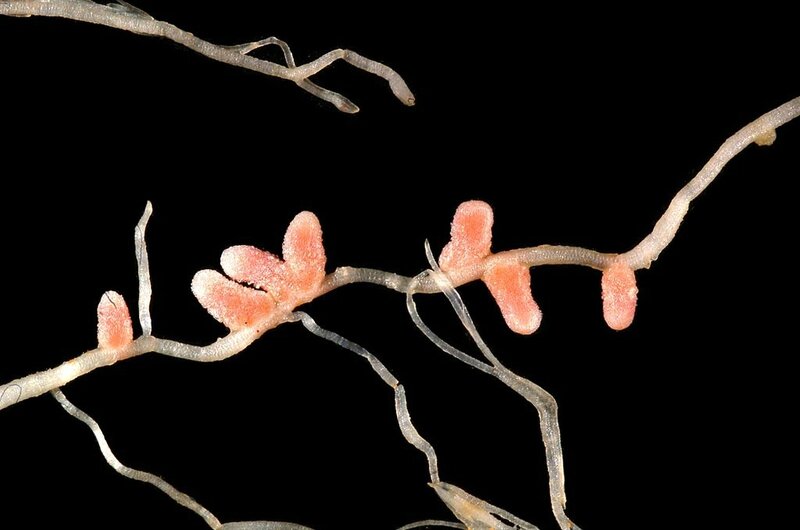
Photographie de nodules à la surface d'une racine de luzerne (Medicago italica). Ces nodules sont le siège d'une association entre la plante et des bactérie Rhizobiacées. Ces dernières fixent le diazote atmosphérique et fournissent la plante en azote minéral utilisable en bénéficiant d'une partie des sucres produits par la photosynthèse par la plante. (Photo : Ninjatacoshell)
Des travaux très récents d’Erik Hom et son collègue Andrew Murray de l’Université d’Harvard aux Etats-Unis, publiés dans la revue Science, apportent quelques éléments de réponse à ces questions grâce à une démarche expérimentale simple et intéressante. Ces deux biologistes ont utilisé deux organismes modèles couramment employés dans les laboratoires, la levure de la bière (Saccharomyces cerevisiae) et une algue verte unicellulaire répondant au petit nom de Chlamydomonas reinhardtii.
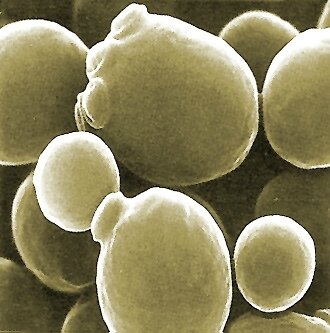
Photographie au microscope électronique à balayage de Levures de la bière (Saccharomyces cerevisiae). Les petits renflements visibles à la surface de certaines cellules correspondent à des bourgeons qui témoignent d'une multiplication asexuée. (Photo : AJ Cann)
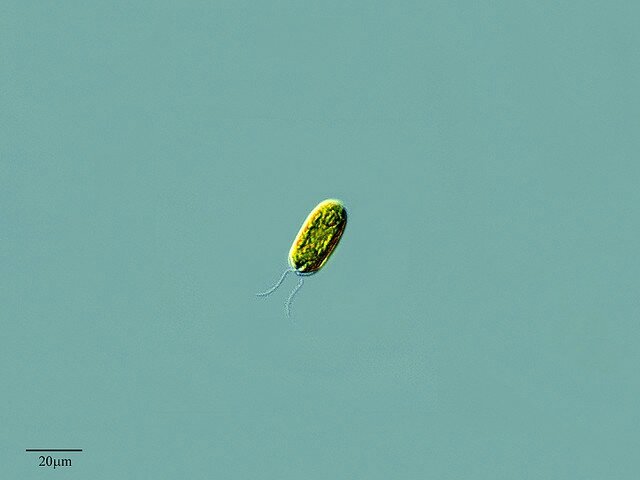
Photographie au microsocope photonique d'une cellule de Chlamydomonas reinhardtii, une algue verte unicellulaire pourvue de deux flagelles qui lui permettent de se déplacer, notamment en direction de la lumière qu'elle utilise pour faire la photosynthèse. (Photo : PROYECTO AGUA)
La coopération entre ces deux organismes est inconnue dans la nature mais chacun présente des besoins bien identifiés pour son métabolisme énergétique. L’algue utilise du dioxyde de carbone qu’elle réduit pour produire de la matière organique par photosynthèse. Ce dioxyde de carbone peut être prélevé dans l’eau et dans l’air où il est naturellement présent mais il peut aussi provenir de l’activité respiratoire de la levure qui oxyde de la matière organique comme du glucose en dioxyde de carbone. La levure a quant à elle besoin d’ammoniaque qu’elle utilise dans la synthèse de ses acides aminés et de ses acides nucléiques comme l’ADN et l’ARN. Il se trouve que Chlamydomonas produit de l’ammoniaque en réduisant du nitrite.
Milieux de culture contenant des Chlamydomonas ce qui leur donne leur couleur verte. Les expérience présentées dans cet article ont été réalisées dans ce type d'environnement, agité ou non et dont les compositions étaient étroitement contrôlées au départ. (Photo : wolfgraebel)
Hom et Murray ont donc eu l’idée de mettre les deux organismes en culture dans de nombreux milieux différant par les quantités de glucose, de nitrite et de dioxyde de carbone disponibles. Tout d’abord, l’absence de l’un des deux organismes dans un milieu qui ne contient que du nitrite et du glucose se traduit par une absence de multiplication cellulaire de l’autre organisme. Mais, le résultat le plus surprenant de l’étude est que dans un milieu qui contient du nitrite et du glucose ainsi que les deux organismes, ces derniers se multiplient tous les deux alors qu’il manque à chacun un composé essentiel à son métabolisme. Cette expérience démontre l’existence d’une coopération entre ces deux êtres vivants unicellulaires. Cependant, elle ne permet pas de se rendre compte de l’étroitesse de cette coopération. En comparant ce premier résultat avec une expérience dans laquelle la culture des deux organismes est soumise à une agitation qui perturbe les contacts éventuels entre cellules, il devient possible de conclure sur ce point. Précisément, l’agitation de la culture entraîne une diminution de la croissance des populations des deux espèces ce qui montre que le contact entre les cellules de levures et d’algues favorise la coopération. Il s’agit donc bien là de la mise en place d’une véritable symbiose entre deux organismes modèles en laboratoire ! Celle-ci est d’ailleurs observée dans des milieux de culture contenant des concentrations très variables en glucose et en nitrite et ne résulte donc pas d’un ajustement très fin des conditions expérimentales. Toutefois, si on ajoute du dioxyde de carbone, en laissant les tubes de culture ouverts, l’algue verte croît et élimine la levure ce qui démontre que ce sont les conditions environnementales qui sélectionnent, ou pas, la mise en place d’une symbiose, cela se faisant sans coévolution antérieure entre les deux organismes concernés. Hom et Murray ont justement exploré le champ des possibles coopérations entre algues vertes unicellulaires et levures en répliquant leurs séries d’expériences à des organismes phylogénétiquement plus ou moins proches des deux organismes testés initialement. Les résultats indiquent que le degré de parenté avec la levure de bière ou Chlamydomonas n’est pas l’élément principal contrôlant la possibilité de coopérer. Ce sont en fait les caractéristiques métaboliques des êtres vivants utilisés qui sont déterminantes. Ainsi, l’algue Chlorella vulgaris, qui peut utiliser le glucose comme source de carbone organique, élimine les levures du milieu de culture ce qui peut s’interpréter par le fait qu’il ne manque rien à l’algue pour se multiplier.
Photographie au microscope électronique à transmission d'une cellule de Chlamydomonas reinhardtii dans laquelle on observe des lamelles qui correspondent au chloroplaste, une cyanobactérie phagocytée par une cellule eucaryote non photosynthétique, et des mitochondries qui sont aussi des bactéries vivant en endosymbiose avec la cellule qui les contient.
Cette étude apporte par conséquent des preuves expérimentales que la mise en place de symbioses permettant des coopérations métaboliques peut s’effectuer rapidement entre des organismes dont les lignées ont pourtant divergé depuis plusieurs centaines de millions d’années sans qu’il y ait besoin d’une coévolution préalable. Il est bien sûr prématuré de généraliser ces résultats à toutes les symbioses, mais ils viennent tout de même briser le mythe d’une complexité mystérieuse des symbioses que nous connaissons actuellement comme celles qui sont légion dans le sol entre végétaux et microorganismes. Ces travaux montrent également toute l’importance de l’environnement qui impose des contraintes et donc une sélection de ces relations de coopérations qui s’en trouvent forcément stabilisées. Ces expériences menées sur des organismes unicellulaires ne sont pas non plus sans nous rappeler nos propres origines, puisqu’au cœur même de chacune de nos milliards de cellules se trouvent des témoins de la mise en place de coopérations ancestrales, entre les cellules eucaryotes et des bactéries devenues mitochondries et chloroplastes.






/http%3A%2F%2Fstorage.canalblog.com%2F86%2F04%2F1238219%2F95602296_o.jpg)
/http%3A%2F%2Fstorage.canalblog.com%2F46%2F92%2F1238219%2F95428887_o.jpg)
/http%3A%2F%2Fstorage.canalblog.com%2F50%2F47%2F1238219%2F94844412_o.jpg)
/http%3A%2F%2Fstorage.canalblog.com%2F19%2F37%2F1238219%2F109452445_o.jpg)
/https%3A%2F%2Fprofilepics.canalblog.com%2Fprofilepics%2F5%2F4%2F545753.jpg)